A Anvisa aprovou nesta quinta-feira (16/12) a indicação da vacina Comirnaty para imunização contra Covid-19 em crianças de 5 a 11 anos de idade. A aprovação permite o início do uso da vacina no Brasil para esta faixa etária.
A autorização veio após uma análise técnica criteriosa de dados e estudos clínicos conduzidos pelo laboratório. Segundo a equipe técnica da Agência, as informações avaliadas indicam que a vacina é segura e eficaz para o público infantil, conforme solicitado pela Pfizer e autorizado pela Anvisa.
A avaliação da Agência levou 21 dias, descontados os 14 dias que a Pfizer utilizou para responder exigências técnicas da Anvisa.
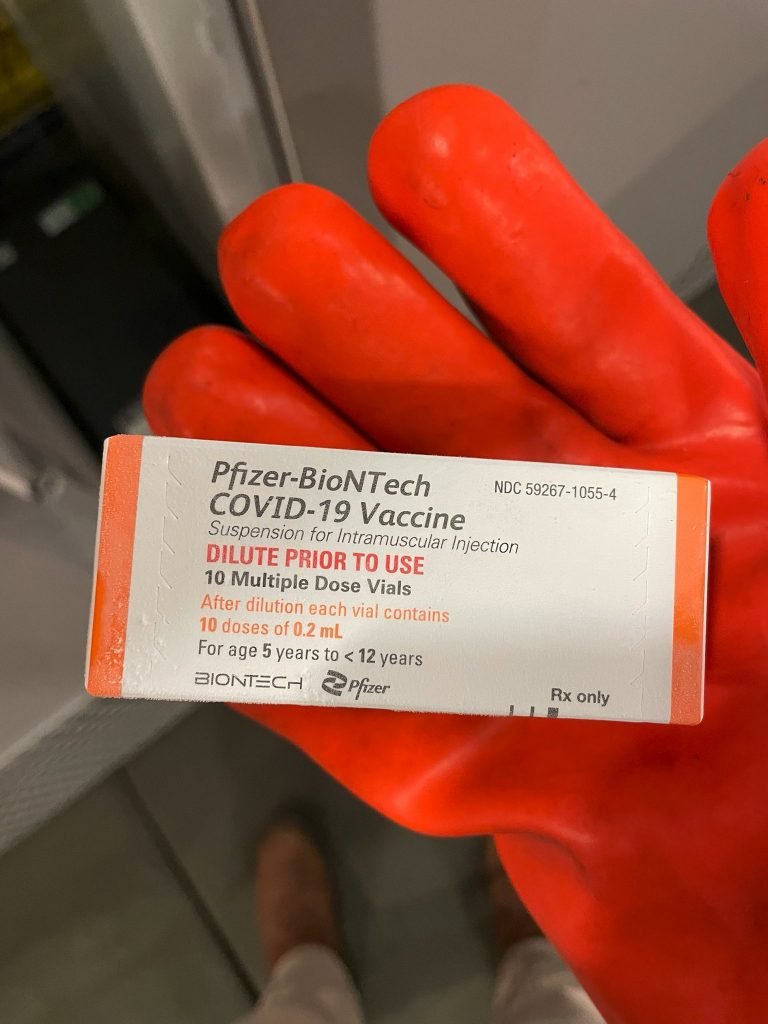
Tampa laranja e outros detalhes sobre a vacina
A vacina para crianças tem dosagem e composição diferentes daquela utilizada para os maiores de 12 anos.
A formulação da vacina para crianças será aplicada em duas doses de 0,2 mL (equivalente a 10 microgramas), com pelo menos 21 dias de intervalo entre as doses.
A tampa do frasco da vacina virá na cor laranja, para facilitar a identificação pelas equipes de vacinação e também pelos pais, mães e cuidadores que levarão as crianças para serem vacinadas. Para os maiores de 12 anos, a vacina, que será aplicada em doses de 0,3 mL, terá tampa na cor roxa.
A vacina também tem esquema de conservação diferente, já que pode ficar por 10 semanas em temperatura de 2ºC a 8ºC.
Anvisa contou com especialistas externos
Para a avaliação da ampliação da faixa etária dessa vacina, a Agência contou com a consulta e o acompanhamento de um grupo de especialistas em pediatria e imunologia que teve acesso aos dados dos estudos e resultados apresentados pelo laboratório.
O olhar de especialistas externos foi um critério adicional adotado pela Anvisa para que o uso da vacina por crianças fosse aprovado dentro dos mais rigorosos critérios, considerando para isso o conhecimento de profissionais médicos que atuam no dia a dia com crianças e imunização.
Participaram especialistas da Associação Brasileira de Saúde Coletiva (Abrasco), Sociedade Brasileira de Pneumologia e Tisiologia (SBPT), Sociedade Brasileira de Infectologia (SBI), Sociedade Brasileira de Imunologia (SBI) e Sociedade Brasileira de Pediatria (SBP).
Histórico da vacina no Brasil
12 de novembro – Pedido de inclusão da faixa etária de 5 a 11 anos chega à Anvisa.
23 de novembro – Agência envia exigências técnicas ao laboratório.
3 de dezembro – Anvisa se reúne com especialistas externos para tratar sobre a vacina.
6 de dezembro – Exigências são respondidas pela Pfizer.
12 de dezembro – Anvisa realiza reunião com representantes de sociedades médicas e Pfizer.
16 de dezembro – Anvisa autoriza a vacina da Pfizer para crianças de 5 a 11 anos de idade.
A vacina da Pfizer está registrada no Brasil desde o dia 23 de fevereiro de 2021. Em 11 de junho deste ano, a Anvisa já havia autorizado a indicação da vacina para a faixa etária de 12 a 16 anos.
Quando começa a vacinação
A aprovação da Anvisa permite que a vacina já seja usada no país para a faixa etária de 5 a 11 anos. A chegada do imunizante aos postos depende do calendário e da logística do Programa Nacional de Imunizações do Ministério da Saúde (PNI/MS), que coordena a distribuição das vacinas por meio de programas públicos no Brasil.